
|

|
Soliris因被福布斯评为“世界上最昂贵的药物”一炮而红,它使用一年的价格是409500美元。
Soliris(Eculizumab,依库珠单抗的商品名)是直接作用于补体C5的一类新型人源性单克隆抗体,是由美国亚力兄(Alexion)公司开发的用于治疗阵发性睡眠性血红蛋白尿的药品。阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)是一种罕见的血液疾病,大约8000个美国人受其困扰。它是一种获得性造血干细胞克隆性疾病, 以发作性血管内溶血、静脉血栓形成、骨髓造血功能衰竭为主要表现。其病理机制主要是位于X 染色体上的PIG-A基因突变,导致血细胞膜表面糖化磷脂酰肌醇(GPI)锚连蛋白的减少或缺乏,从而使血细胞对补体的敏感性增强而发生血管内溶血。此病好发年龄为25~45岁,病程多为15年左右,临床上较少见,日本统计发病率为0.1/10万~0.3/10万。我国北方报道的病例要多于南方,男性多于女性。该病虽为良性克隆性疾病,但起病急骤、病情反复、迁延不愈、生存质量差、存活期短。
PNH尚缺乏特效治疗方法,到目前为止异基因骨髓移植是临床惟一有效的治疗方法, 隔日应用泼尼松治疗有时可以改善PNH的溶血,但大部分患者无效或疗效甚微。而单克隆抗体Eculizumab通过抑制补体终末阶段的级联放大反应,可有效控制PNH的溶血及其他症状。
Eculizumab是2007年FDA批准的Alexion制药公司的首个药物。Alexion是1992年由一位在耶鲁执教的执业医生Leonard Bell在美国康涅狄格州纽黑文市成立的公司;1996年该公司以ALXN之名在在纳斯达克上市;2002年开始进行Eculizumab用于PNH的研究;2004年新英格兰医学杂志发布该单抗用于PNH患者获得积极结果;2005年Eculizumab开始进入欧洲,用于PNH患者的临床试验;2006年新英格兰医学杂志再次发布该单抗用于PNH研究的非常积极的临床数据;2007年美国和欧洲先后批准Soliris用于PNH患者,截止目前为止,有超过40个国家批准该产品用于PNH患者;2008年在德国和法国开展Soliris用于非典型溶血尿毒综合征(aHUS);2008年Eculizumab接受有"医药界的诺贝尔奖"的盖伦奖“Best Biotechnology Product with Broad Implications for Future Biomedical Research”的称号;2009年分别获法国和日本颁发的“罕见病药”称号;2011年美国和欧洲先后批准Soliris用于aHUS患者。aHUS是罕见的、威胁生命的遗传性疾病;会逐渐地损坏人体重要的器官,导致中风、心脏病、肾功能衰竭和死亡。
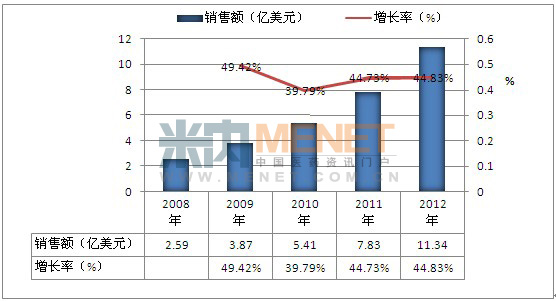
从1992年建立公司到2008年获利,Alexion经过了17年的潜心研究,但是后来Soliris的销售数据证明这样的等待是值得的。自08年获得超过2亿美元的销售收入后,短短5年,该产品正式进入重磅药的行列。
图1 近几年Soliris的销售数据
Soliris如此的昂贵,为什么还会获得FDA的优先审批。这是因为它是罕见病的救命药。价格高昂是因成本高昂,根据美国制药工业协会的统计数据,开发和上市一种新药,在欧洲的成功率为1/4317,美国仅为1/6155,同时新药获准上市并不意味着商业上的成功。因此,很少企业愿意在孤儿药研发上投入精力。1983年美国国会通过了孤儿药法案(ODA),以鼓励制药公司对罕见疾病药物的研发,为孤儿药的注册提供快速通道程序,还享有减税并且无论专利状态,给予7年的市场独占权。而后世界各国陆续出台类似罕见病药物的相关法律,激励了医药公司对罕见病药物的研发,也大大加速了罕见病药物的上市。有研究显示,自2008年以来陆续有孤儿药的销售达到了“重磅炸弹”标准,Soliris就是其中的典型,虽然价格昂贵,但与它的效果比起来,又确实是物有所值:研究表明Soliris能够将因PNH导致的严重并发症和其他致命症状减少90%。
我国目前对罕见病没有官方的权威定义,病种与患病人数也少有报道。如按WHO定义罕见病的发生率0.65%~1%计算,我国现阶段罕见病患者超过千万。虽然2009年我国颁布实施《新药注册特殊审批管理规定》,将罕见病用药审批列入特殊审批范围,但到目前为止暂无自主研发的罕见病药物上市,患者依然需依赖高价进口药。近日,CFDA下发《药品注册管理办法》修正案(草案)征求意见稿,强调了与专利法的衔接,会否是罕见病药物研发的一个重大利好呢。(来源:米内网)
